SEL ELEKTROLISIS
Elektrolisis adalah sel elektrokimia yang menimbulkan terjadinya reaksi redoks yang tidak spontan dengan adanya energi listrik dari luar. Pada sel elektrolisis, katoda bermuatan negatif dan anoda bermuatan positif.
Sel elektrolisis terdiri dari sebuah wadah, elektroda, elektrolit, dan sumber arus searah.Elektron (listrik) memasuki sel elektrolisis melalui kutub negatif (katoda). Spesi tertentu dalam larutan menyerap elektron dari katoda dan mengalami reduksi. Dan spesi lain melepas elektron di anoda dan mengalami oksidasi. Namun, muatan elektrodanya berbeda.Spesi apa yang terlibat dalam reaksi katoda dan anoda bergantung pada potensial elektroda dari spesi tersebut. Potensial elektroda juga dipengaruhi konsentrasi dan jenis elektrodanya. Spesi yang mengalami reduksi di katoda (bermuatan negatif) adalah spesi yang potensial reduksinya paling besar. Spesi yang mengalami oksidasi (bermuatan positif) di anoda adalah spesi yang potensial oksidasinya paling besar.
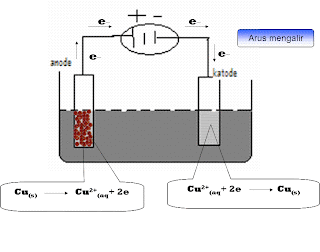
- Pada elektrolisis larutan CuSO4 dengan katoda grafit dan anoda Cu terbentuk endapan Cu di Katode dan anodanya (Cu) larut. Disertai pembebasan O2
- Dalam larutan CuSO4 terdapat ion Cu2+, ion SO42-, molekul air serta logam tembaga (anode).
- Oleh karen potensial oksidasi Cu paling besar maka oksidasi tembaga lebih mudah berlangsung. Jadi, elektrolisis larutan CuSO4 dengan katoda grafit dan anode Cu menghasilkan endapan Cu di katoda dan melarutkan Cu di anoda.